
在拟南芥中,热休克转录因子A1b(HEAT SHOCK TRANSCRIPTION FACTORA1b,HSFA1b)通过影响种子产量来调控对环境胁迫的抗性。HSFA1b是生殖适应性的决定性因素,这种调控机制怎么形成的呢?
2018年,英国生物-植物科学类期刊Journal of Experimental Botany《实验植物学杂志》发表了题为“Arabidopsis HEAT SHOCK TRANSCRIPTION FACTORA1b regulates multiple developmental genes under benign and stress conditions”的研究论文,通过染色质免疫共沉淀测序(ChIP-seq)等组学分析揭示了拟南芥热休克转录因子A1b在调节植物高温胁迫响应的分子机制。

标题:Arabidopsis HEAT SHOCK TRANSCRIPTION FACTORA1b regulates multiple developmental genes under benign and stress conditions 拟南芥热休克转录因子A1B在良性和胁迫条件下调节多个发育基因
时间:2018-04-25
期刊:J Exp Bot
影响因子:IF 7.298
技术平台:ChIP-seq、RNA-seq等
研究摘要:
本研究通过对野生型非胁迫(NS)(对照组)拟南芥与热激(HS)(热激组)拟南芥HSFA1b的ChIP-seq测序分析、热激组与对照组的表达图谱分析(RNA-seq)、蛋白结合图谱与表达图谱关联分析等研究,共鉴定出952个差异表达的HSFA1b靶基因,其中至少85个与发育相关且主要在NS下结合。同时鉴定出1780个基因差异表达,但未与HSFA1b结合,其中281个具有发育相关功能。这些基因通过27个转录因子(TF)的分层网络间接调控。此外本研究鉴定了与HSFA1b结合的480个反义RNA基因(cisNAT),揭示了进一步的间接调控模式。最后,HSFA1b靶向基因组特征不仅包含热休克元件,还包含了MADS-box、LEAFY和G-box启动子motif,表明HSFA1b是靶向共同应激防御和发育基因的八个转录因子(TF)之一。总之,本研究结果表明HSFA1b将环境线索诱导至许多应激反应和发育基因,使植物能在不同环境中不断调整其生长和发育。
项目设计:
(1) 样本选取:
5周龄NS和HS的NP:HSFA1b和Col-0拟南芥植物的完全展开叶片样品用于ChIP-seq和RNA-seq实验
(2)项目设计流程图:
研究结果:
(1)在HS条件下HSFA1b优先结合其靶基因的上游和TSS区域
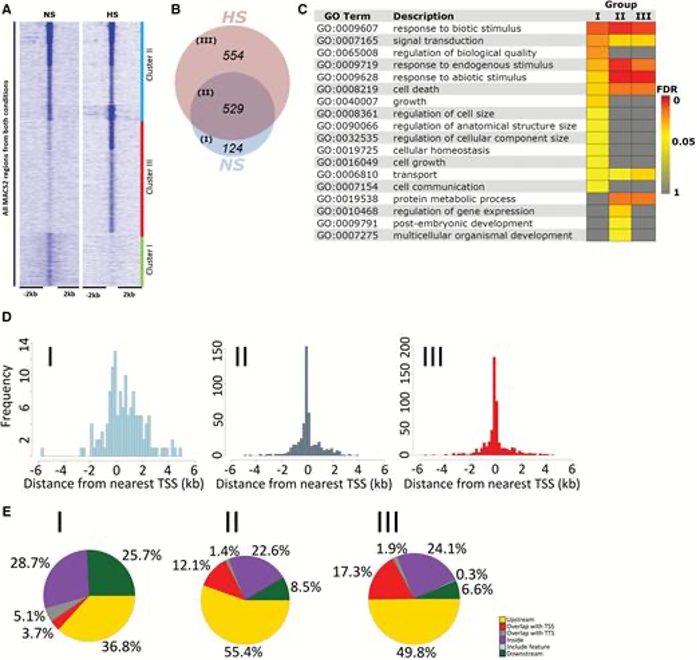
图1:响应HS的HSFA1b结合的变化
(A)对照和热激条件下HSFA1b结合位点富集与聚类
(B)结合位点的重叠分析
(C)三类结合位点的GO富集分析对比
(D)三类结合位点在TSS位点附近的分布
(E)三类结合位点在基因组元件上的分布
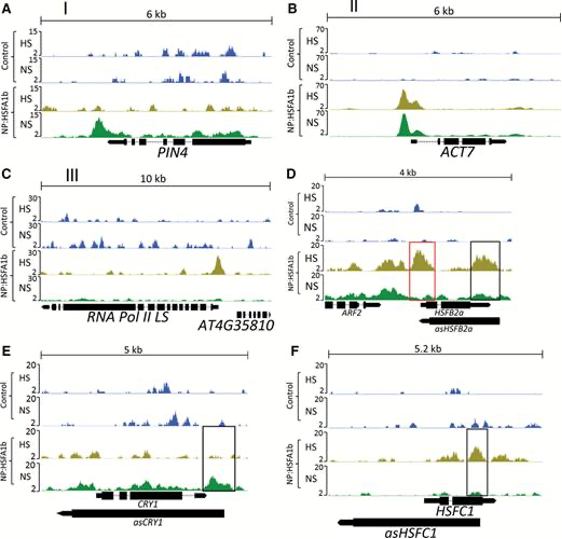
图2:HSFA1b典型结合位点的IGV展示
(A-C)示意三类结合位点
(D-F)示意靶向反义RNA的结合位点
(2)大多数HSFA1b靶基因都对热激敏感
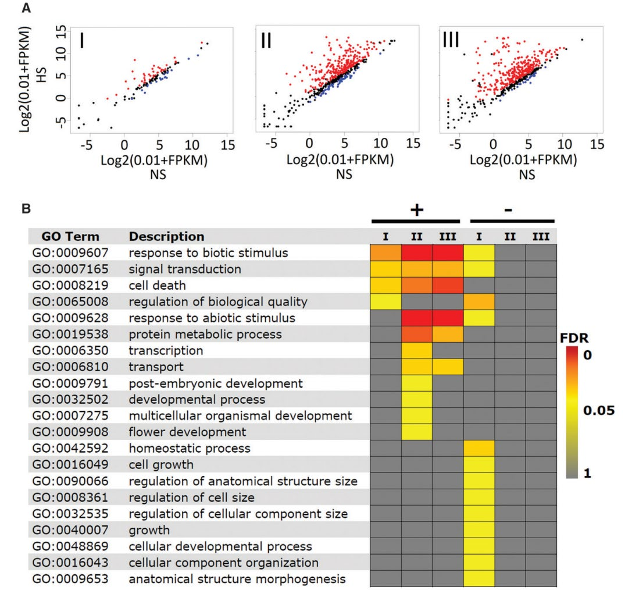
图3:RNA-seq分析三类HSFA1B靶基因的表达
(A)三类HSFA1b靶基因的差异表达分析(NS vs. HS)
(B)三类HSFA1b靶基因中上调和下调基因的GO功能富集分析
(3)过表达HSFA1b部分模拟拟南芥热激反应
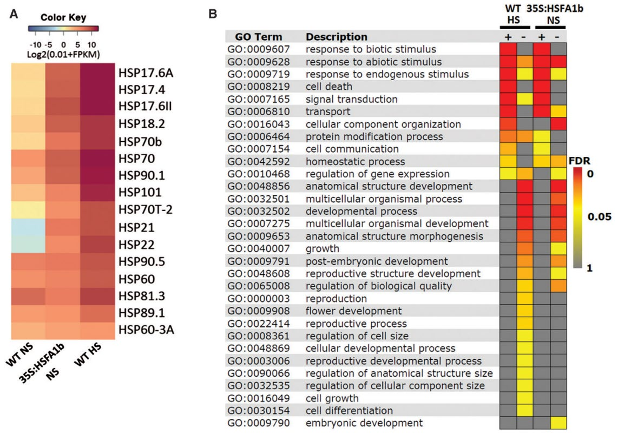
图4:过表达HSFA1b部分模拟拟南芥热激反应
(A)热激蛋白(HSP)在对照组、HSFA1b过表达组和热激组之间的表达热图
(B)HSFA1b过表达组和热激组之间差异上下调基因的GO功能富集分析
(4)HSFA1b可通过调控TF表达间接调控下游靶基因表达
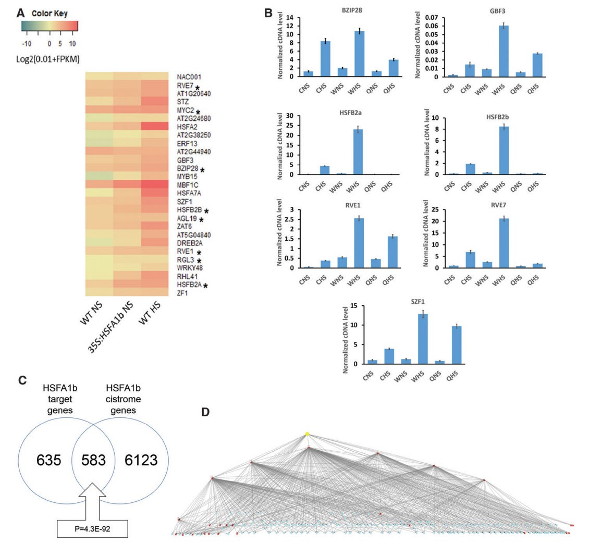
图5:HSFA1b可以通过调控TF基因表达来间接调控下游靶基因表达。
(A)差异HSFA1b靶转录因子(TF)在对照组、HSFA1b过表达组和热激组之间的表达热图
(B)RT-qPCR挑选部分把靶TF基因进行表达验证
(C)本研究CHIP-seq鉴定的HSFA1b靶基因与拟南芥顺反组图谱数据库(Arabidopsis Cistrome Atlas)中HSFA1b靶基因的重叠分析
(D)基于本研究CHIP-seq和RNA-seq数据库推导的HSFA1b分层调控网络。黄色节点是HSFA1b,红色节点是其结合的TF,蓝色节点是TF调控的下游差异表达基因。
(5)HSFA1b调控反义RNA基因(cisNAT)及其靶基因的表达
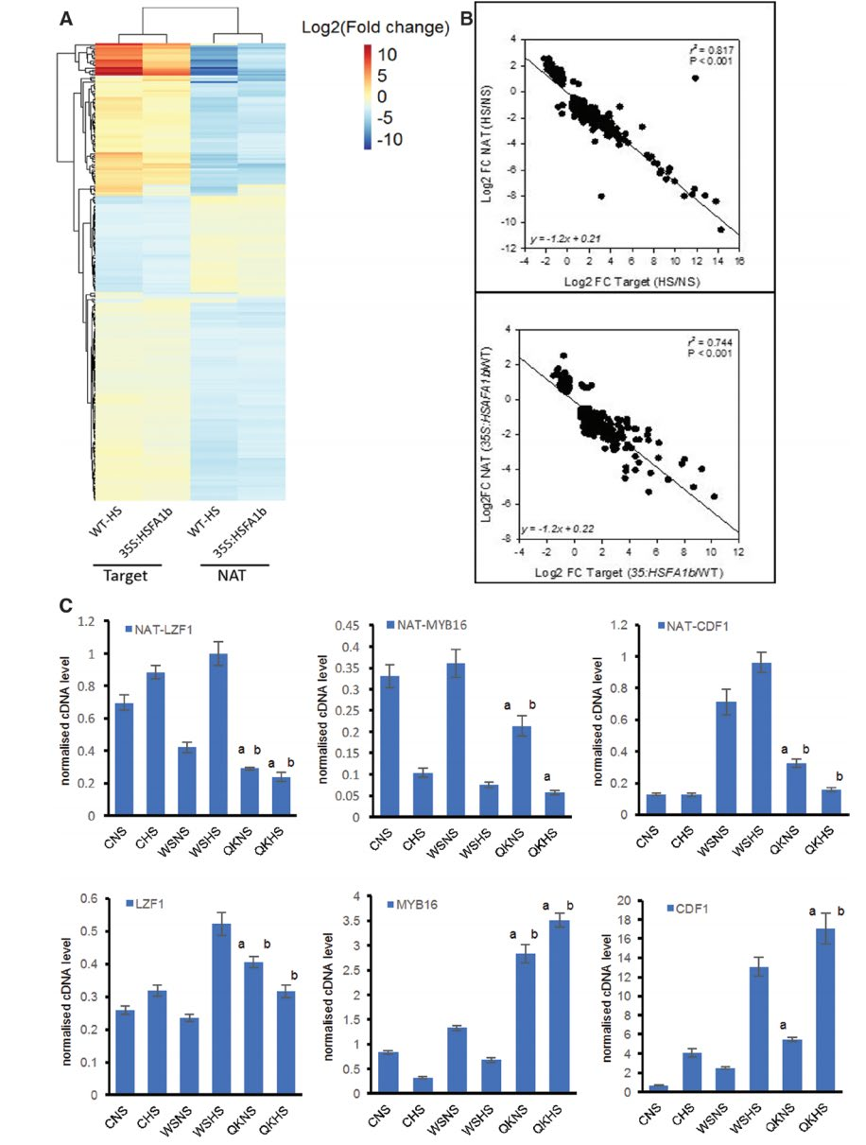
图6:HSFA1b调节顺式NAT基因及其靶基因表达
(A)RNA-seq数据鉴定的反义RNA及其预测靶基因的差异表达热图
(B)反义RNA及其预测靶基因的表达变化负相关
(C)RT-qPCR验证反义RNA及其预测靶基因的表达
(6)HSFA1b是八种调节应激基因的转录因子之一
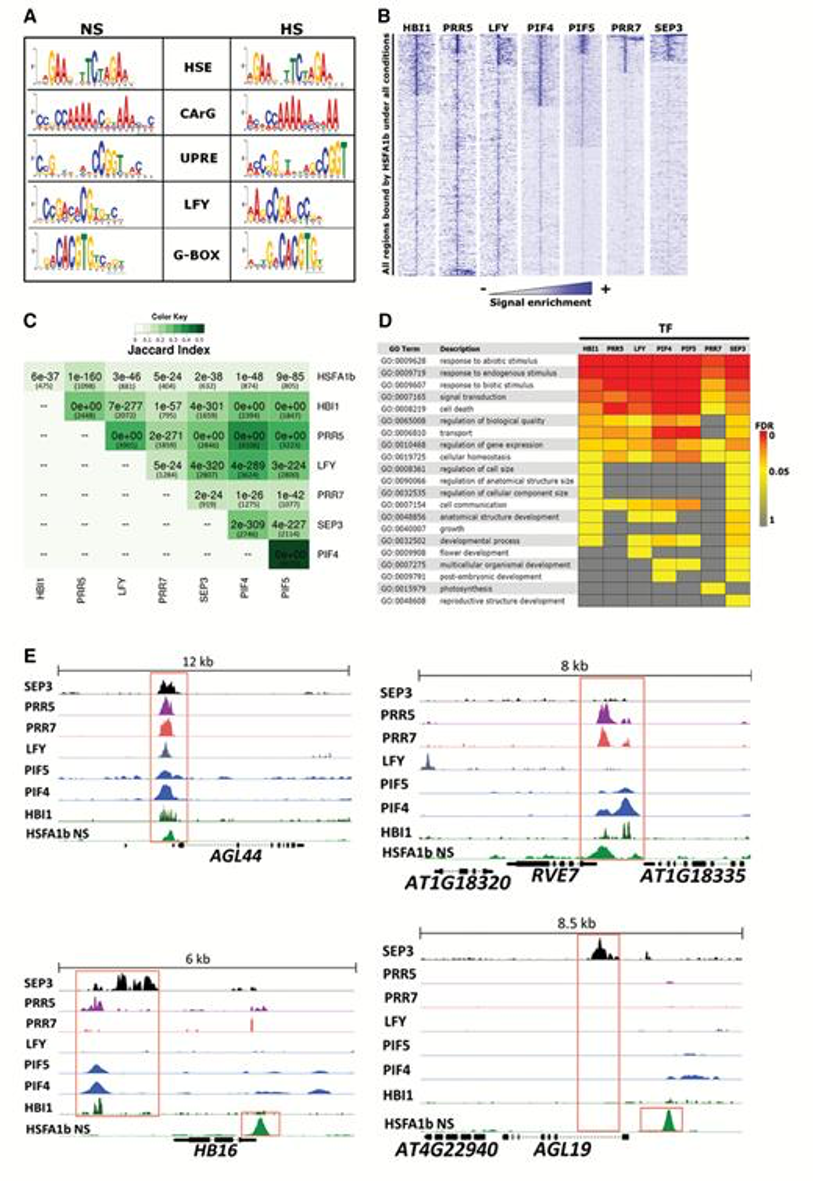
图7:已发表的7个TFs的ChIP-seq数据表明,它们与NS和HS下的HSFA1b靶区存在显著重叠的靶基因
(A)HSFA1b结合区域的TF motif分析;
(B)各TF-motif在HSFA1b结合区域的富集热图;
(C)HSFA1b和7个共定位TF的靶基因重叠分析;
(D)HSFA1b和7个共定位TF的重叠靶基因的GO富集分析
(E)由HSFA1b和多达7个其他转录因子结合的典型靶基因的IGV展示。
关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
Ø 转录因子和辅因子结合作用
Ø 复制因子和 DNA 修复蛋白
Ø 组蛋白修饰和变异组蛋白
技术优势:
Ø 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
Ø 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
Ø 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:
有ChIP-seq测序或组学研究需要的老师可联系易基因:0755-28317900。
参考文献:
Albihlal WS, Obomighie I, Blein T, Persad R, Chernukhin I, Crespi M, Bechtold U, Mullineaux PM. Arabidopsis HEAT SHOCK TRANSCRIPTION FACTORA1b regulates multiple developmental genes under benign and stress conditions. J Exp Bot. 2018 May 19;69(11):2847-2862.
相关阅读:
手把手教你做染色质免疫共沉淀测序(ChIP-seq)分析实验
干货系列:染色质免疫共沉淀测序(ChIP-seq)的数据挖掘思路