
2020年9月29日,《Cell Death Discovery》(IF: 7.109)杂志发表了题为“A defined N6-methyladenosine (m6A) profile conferred by METTL3 regulates muscle stem cell/myoblast state transitions”的研究论文,研究通过MeRIP-seq(m6A-seq)等实验鉴定了通过Mettl3在mRNA上的m6A沉积是否是体外和体内肌肉特异性成体干细胞(MuSC)/成肌细胞状态的调控因子。

标题:A defined N6-methyladenosine (m6A) profile conferred by METTL3 regulates muscle stem cell/myoblast state transitions(METTL3介导的m6A甲基化谱调控肌肉干细胞成肌细胞状态转换)
时间:2020.9.29
期刊:Cell Death Discovery
影响因子:IF 7.109
技术平台:MeRIP-seq、RNA-seq、m6A液相色谱/质谱(LC-MS)、RT-PCR等
项目设计
(1)样本选取:
Cg-Pax7 tm1(Cre / ERT2)Gaka / J小鼠(JAX:017763)与B6N.129S6-Gt(ROSA)26Sor tm1(CAG-tdTomato *,-EGFP)/ Ees / J小鼠杂交( JAX:005304)产生小树:Pax7 CreERT2;Rosa26 nTnG(以下称为Pax7 nTnG)。Pax7 nTnG小鼠用于所有肌肉损伤实验。普遍表达荧光素酶的小鼠FVB-TG(CAG-luc, -GFP)L2G85Chco / J(JAX:008450, CMV-luc小鼠)被用于分离供体细胞进行移植实验并被移植到免疫缺陷的NSG小鼠中(NOD. Cg-Prkdc scid Il2rg tm1Wjl / SzJ,JAX:005557)。
(2)项目设计流程图:
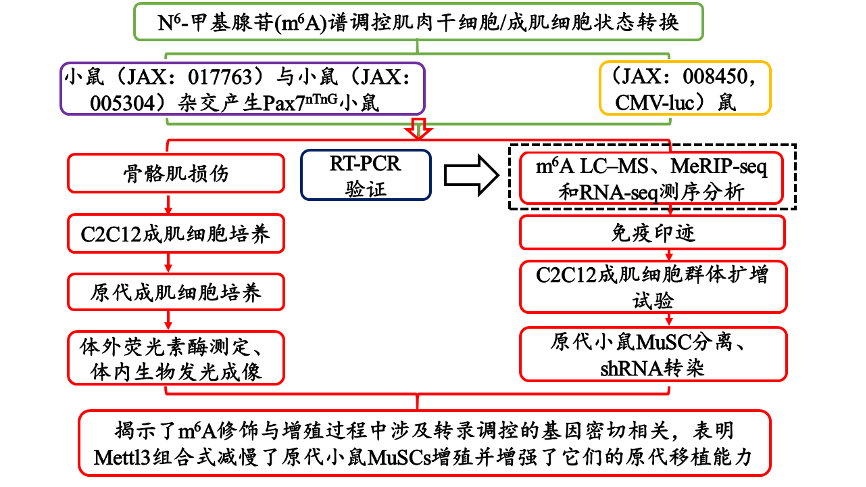
研究目的
肌肉特异性成体干细胞(MuSCs)为骨骼肌再生所必需。为确保损伤后骨骼肌的有效再生,MuSCs必须经历从静止状态被激活的状态转换,从而产生大量增殖的成肌细胞,并继续进行终末分化,修复或替换受损的肌纤维,或者自我更新以重新填充静止的细胞群。MUSC/成肌细胞状态的变化伴随着其转录谱的显著动态变化。此前研究已报道鉴定了成体干细胞系统中由m6A writers METTL3介导最丰富的内部mRNA修饰N6-甲基腺苷(m6A)发生了变化,并通过改变这些细胞的转录谱来调控细胞状态转换。本研究目的是确定通过METTL3的m6A修饰沉积是否在体外和体内对MUSC/成肌细胞状态转换起调节作用。研究使用液相色谱/质谱(LC-MS)分析表明在体内骨骼肌再生的早期阶段,整体m6A水平增加;在体外C2C12成肌细胞从增殖状态转变为分化状态时,整体m6A水平下降。使用m6A特异性RNA测序(MeRIP-seq)鉴定了m6A修饰的不同图谱,区分了增殖状态和分化状态的C2C12成肌细胞。RNAi研究表明,降低m6A甲基转移酶METTL3的活性水平可以降低整体m6A水平,并促进C2C12成肌细胞过早分化。在移植前降低原代小鼠MuSC中的METTL3水平可以增强了其在原代移植时的植入能力,但其连续移植能力缺失。总之,本研究证明了METTL3可以调控MuSCs/成肌细胞中的m6A水平,并调控MuSCs/成肌细胞向不同细胞状态的转变。此外本研究为增殖和分化C2C12成肌细胞中的m6A修饰提供了第一个转录组图谱,并揭示了可能调控MuSC/成肌细胞状态转换的新的基因。
实验结果
(1)在MuSC从增殖到分化过程中,整体m6A水平下降
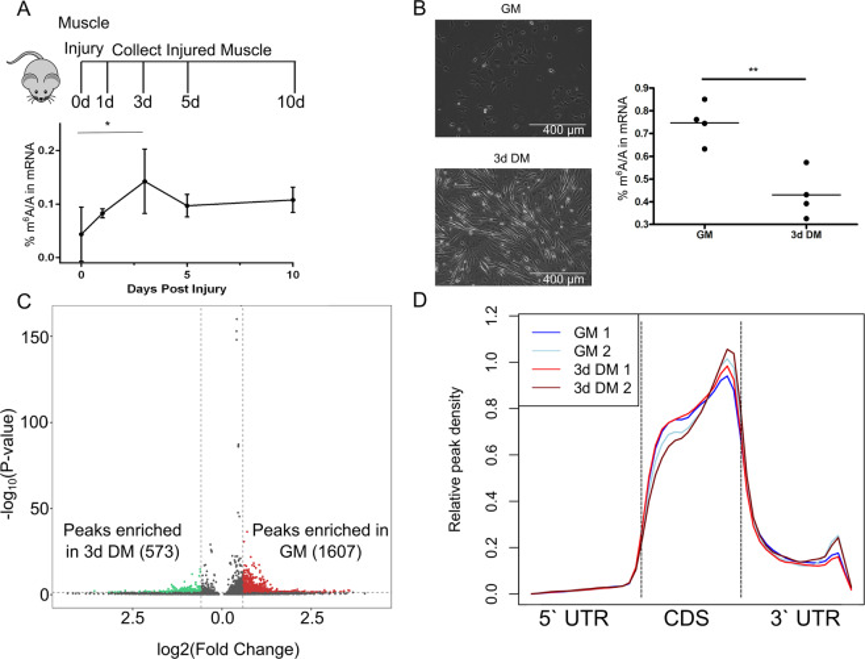
图1:m6A修饰在再生骨骼肌和C2C12成肌细胞中受动态调控
(2)MeRIP-seq揭示了转录本特异性m6A修饰丰度的动态变化,但未揭示转录本上m6A修饰位点的频率变化
为了绘制由m6A标记的转录组在成肌细胞从增殖转换到分化时的动态变化,研究在GM和3d DM样品中进行了MeRIP-seq。MeRIP-seq证实了LC–MS数据,并揭示了在GM(相对于3d DM)样品中m6A修饰的转录本富集。在GM和3d DM样本中,m6A在转录本上的分布相似,最富集在编码序列和3′区域的边界区域。因此可以得出结论,m6A富集的整体和转录本特异性程序与维持成肌细胞在增殖状态有关,并且这种作用并非受转录本上m6A修饰位点差异驱动。
(3)单个转录本水平上的增殖特异性m6A谱的表征
MeRIP-seq分析显示1607 个m6A peaks代表862个富含GM的特异性基因;通过倍数变化> 1.0(GM / 3d DM)确定RNA-seq数据集中转录本表达的增加。MeRIP-seq和RNA-seq数据集之间受影响的分子功能通路的不完全重叠分析表明,GM期间m6A修饰的某些功能结果超出了增强的转录本稳定性和/或衰减。
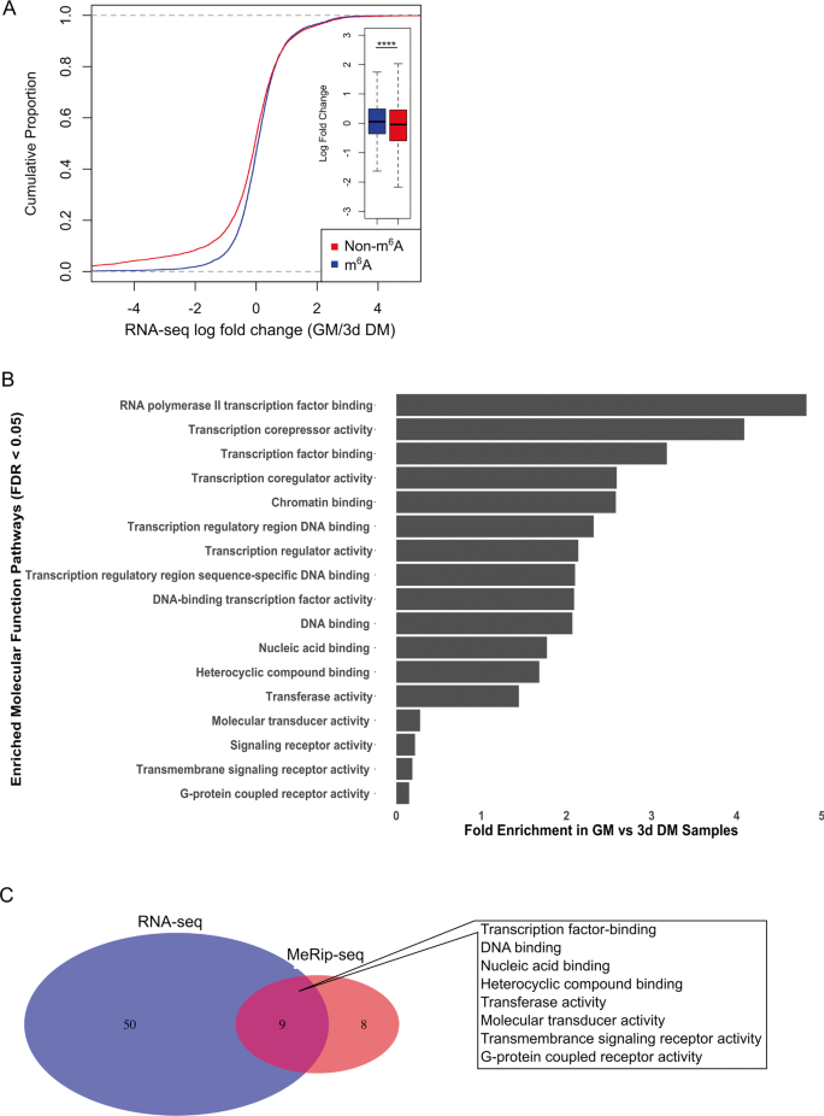
图2:MeRIP-seq分析将转录调控鉴定为C2C12成肌细胞增殖过程中m6A修饰的主要靶点
(4)个体转录水平上分化特异性m6A谱的表征
3d DM MeRIP-seq数据集中富集了m6A的转录本进行了重复分析,鉴定出573 个m6A peaks与340个特异性基因相关,这些基因在3d DM与GM样品中显著富集。PANTHER GO-slim分子功能通路分析显示,与转录调控相关的分子功能通路比GM数据集中的更少。3d DM富集的最主要通路是微管结合(icrotubule binding)。与GM不同的是,MeRIP-seq数据集中鉴定的所有分子功能通路都包含RNA-seq数据集,这表明与GM相比,3d DM中与m6A修饰和转录丰度相关性更强。
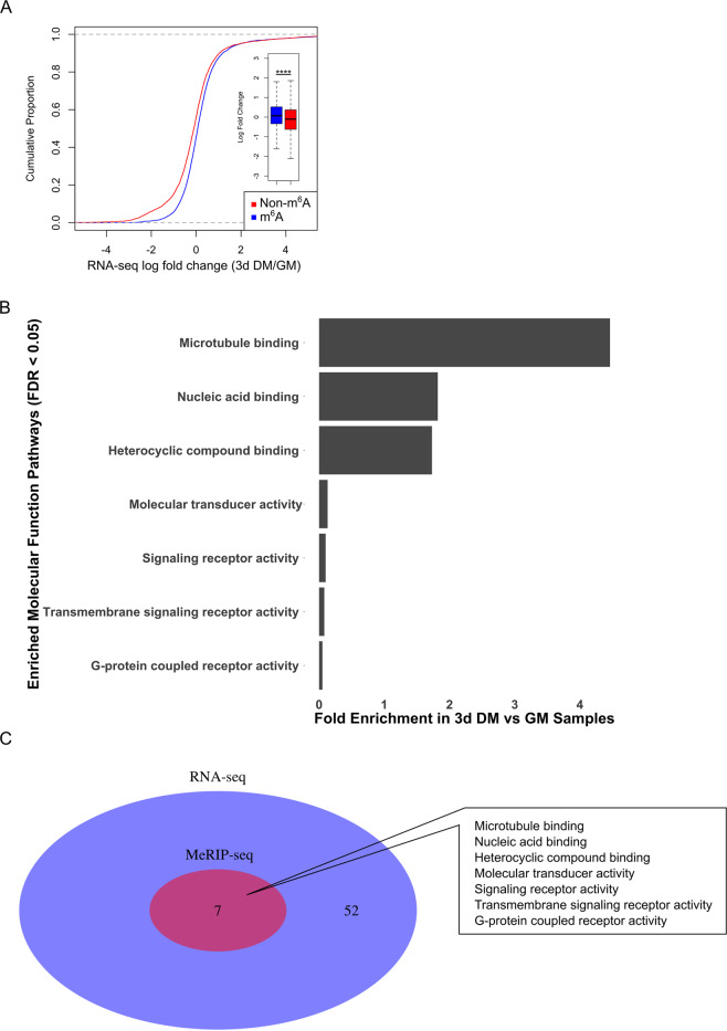
图3:MeRIP-seq分析将微管结合鉴定为C2C12成肌细胞分化过程中m6A修饰的主要靶标
(5) Mettl3调控成肌细胞从增殖到分化的过渡
假设由于活性m6A writers Mettl3表达增加,m6A水平在GM样品中富集。为了模拟再生过程中的MuSC活性,培养C2C12成肌细胞和原代小鼠成肌细胞,然后通过血清限制促使其在体外分化;分化开始后,C2C12成肌细胞(图4a)和原代小鼠成肌细胞(图4b)中的Mettl3表达水平显著下降。
为确定单独m6A修饰沉积是否足以启动分化,用靶向Mettl3的siRNA处理C2C12成肌细胞,其成功地降低m6A修饰,而Mettl3敲低会减少细胞计数。还评估了Mettl3敲低对与增殖(Pax7)、早期分化(Myod1)和晚期分化(Myog)相关的MRF影响。Mettl3敲低后Myod1和Myog的基因表达显著增加,且显著增加表达eMHC的C2C12成肌细胞数量(eMHC是终末分化标志物),这些数据支持一种模型,在该模型中,增殖的C2C12成肌细胞中的Mettl3敲低可降低m6A修饰的整体水平并导致成肌细胞的过早分化。
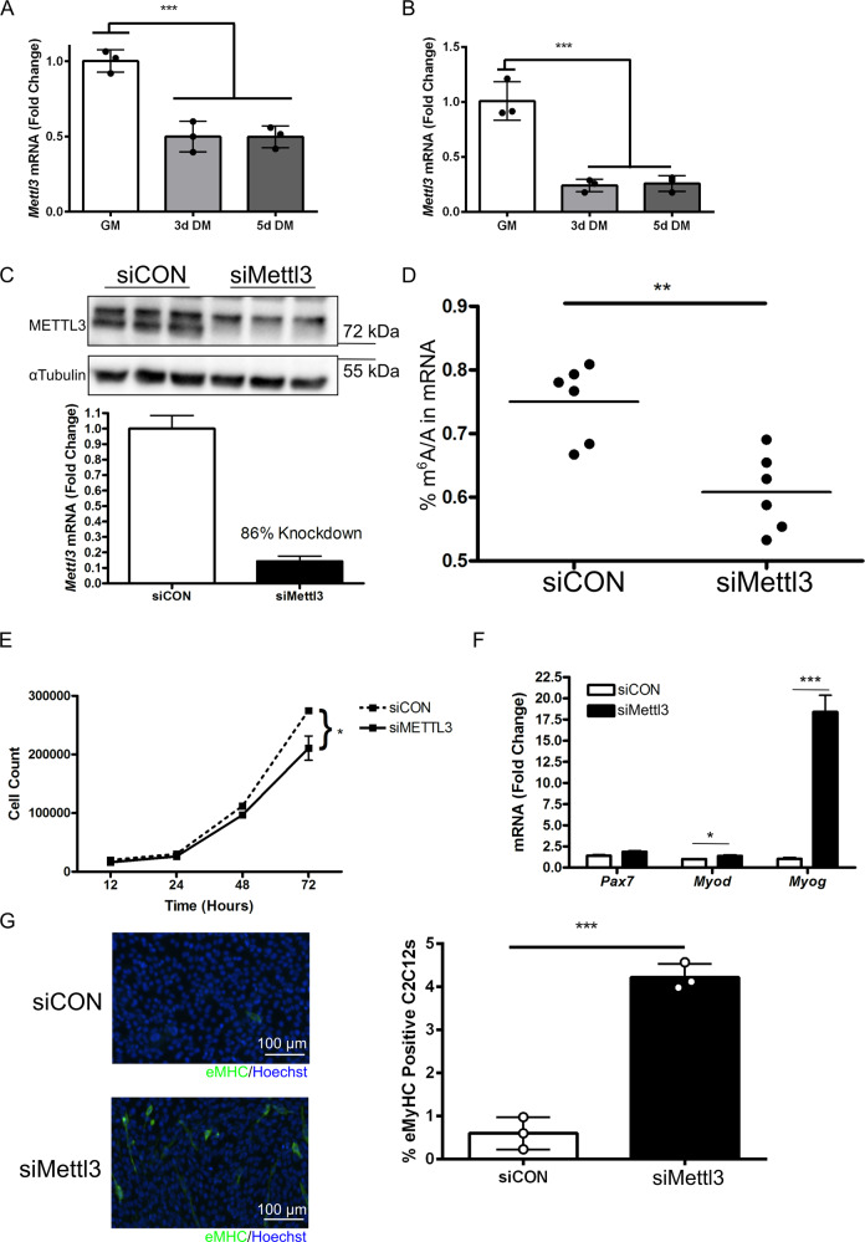
图4:Mettl3敲低促进成肌细胞过早分化
(6)Mettl3基因敲低影响原发性MuSC植入
当在移植前将Mettl3敲低时,移植的MuSC植入和生物发光表达的可能性得到改善。
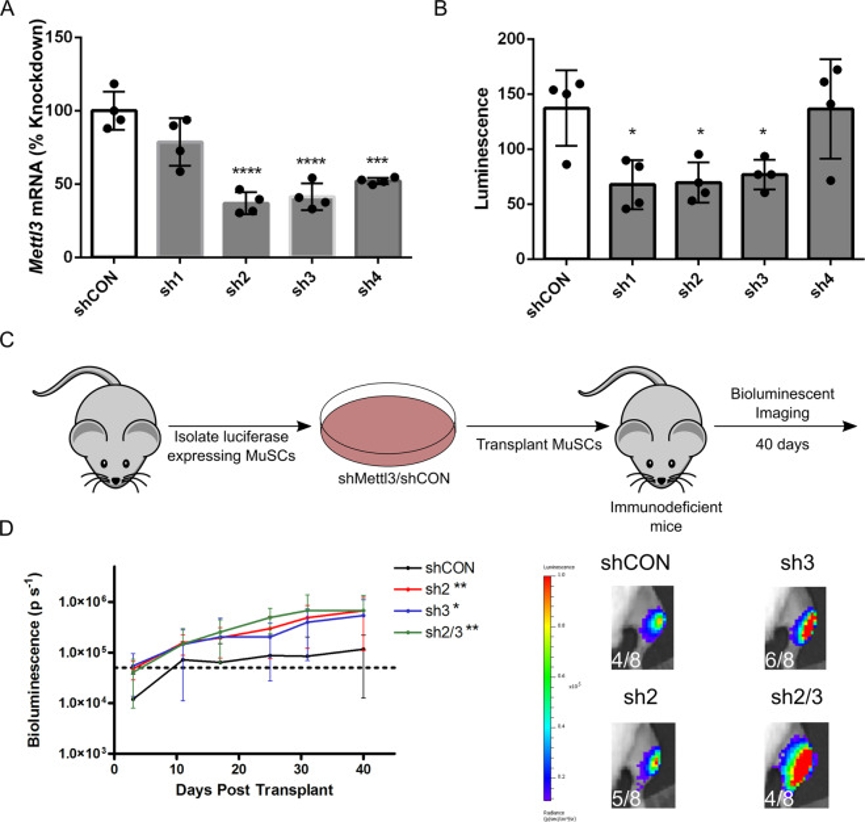
图5:Mettl3敲低增强了初次移植后的MuSC植入
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
技术优势:
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
关于m6A甲基化研究思路
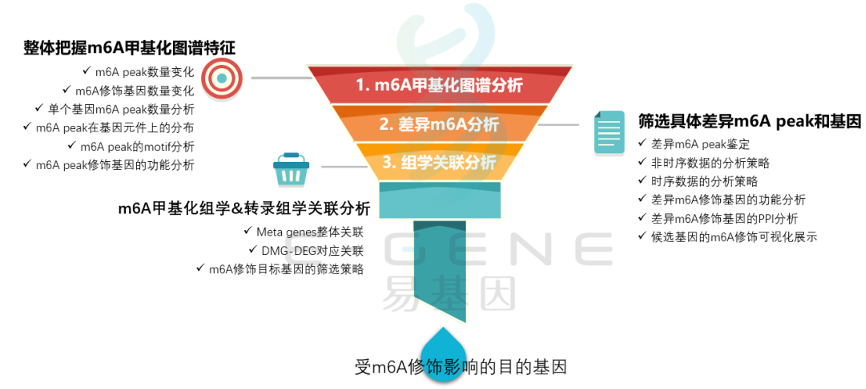
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
易基因科技提供全面的RNA甲基化研究整体解决方案,详询0755-28317900。
参考文献:
Gheller BJ, Blum JE, Fong EHH, Malysheva OV, Cosgrove BD, Thalacker-Mercer AE. A defined N6-methyladenosine (m6A) profile conferred by METTL3 regulates muscle stem cell/myoblast state transitions. Cell Death Discov. 2020;6(1):95.
相关阅读:
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究