
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
肺动脉高压(pulmonary arterial hypertension, PAH)是一种不可逆的心血管疾病,其特征是肺血管阻力进行性增加,最终导致肺动脉高压和右心衰竭。PAH主要成因包括血管收缩、肺血管重塑和细胞外基质(ECM)沉积。肺血管重塑主要由肺动脉平滑肌细胞(PASMCs)的过度增殖和抗凋亡能力引起。PAH是一种涉及遗传、环境和表观遗传等多种因素的复杂疾病。表观遗传变化在血管重塑中的发病机制已被证实,但关于逆转PAH的特定表观遗传靶点的了解仍然有限。
N6-甲基腺苷(m6A)是一种丰富的内源性化学修饰,对RNA的剪接、翻译、定位和稳定性起着关键作用。m6A的动态和可逆性由甲基转移酶(writers)、去甲基化酶(erasers)和不同的m6A结合蛋白(readers)调控。已有研究表明,m6A调控因子的表达失衡与多种生物过程功能障碍有关,包括凋亡/增殖、发育异常、肿瘤进展、自我更新能力降低和免疫系统异常。尽管有证据表明m6A酶失调参与了PAH发病机制,但m6A调控因子在PAH中的具体作用尚未明确。
2024年2月4日,中南大学湘雅二医院凤一路博士为第一作者、宋洁为通讯作者在《Biomedicines》杂志发表题为“Transcriptome-Wide N6-Methyladenosine Alternations in Pulmonary Arteries of Monocrotaline-Induced Pulmonary Arterial Hypertension in Rats and Novel Therapeutic Targets”的研究论文,文章通过甲基化RNA免疫沉淀测序(MeRIP-seq)和RNA转录组测序(RNA-seq)方法,分析单克隆素(MCT)诱导的PAH大鼠模型和对照组肺动脉组织中的mRNA表达和m6A位点变化,通过GO和KEGG通路富集分析进一步分析差异表达基因的功能。探讨了m6A调控因子表达及其在调控PASMC生物学行为中的作用,以揭示潜在的分子机制。

研究摘要:
本研究利用MeRIP-seq和RNA-seq研究对照组和野百合碱(monocrotaline)诱导的PAH大鼠肺动脉组织中m6A和RNA表达差异。使用GO和KEGG进行功能富集分析,研究了差异表达功能。为了筛选候选m6A相关基因,使用STRING和Metascape数据库构建了蛋白质-蛋白质互作(protein-protein interaction,PPI)网络,并通过对候选相关基因表达进行实时PCR验证。使用免疫组化染色、免疫荧光和Western blot技术进一步研究了m6A调控因子的表达水平,并对大鼠肺动脉平滑肌细胞(PASMC)进行增殖实验。研究共鉴定出42个差异表达基因,这些基因的m6A甲基化水平表现出增加或减少(高甲基化或低甲基化)。主要与细胞外基质结构、MAPK和PI3K/AKT通路相关。在PAH组中检测到候选基因着丝粒蛋白F(CENPF)表达增加。研究首次鉴定出一种富含亮氨酸的五肽重复序列(LRPPRC)的m6A reader,该reader在PAH大鼠模型中表达下调。体外实验中,siRNA介导的Lrpprc下调导致大鼠PASMC增殖增强和Cenpf mRNA表达升高。本研究结果揭示了PAH大鼠肺动脉中转录组范围的m6A修饰图谱变化和相关调控机制,可能为未来治疗策略提供新的靶点。深圳市易基因科技为本研究提供MeRIP-seq和RNA-seq技术服务。

研究思路:
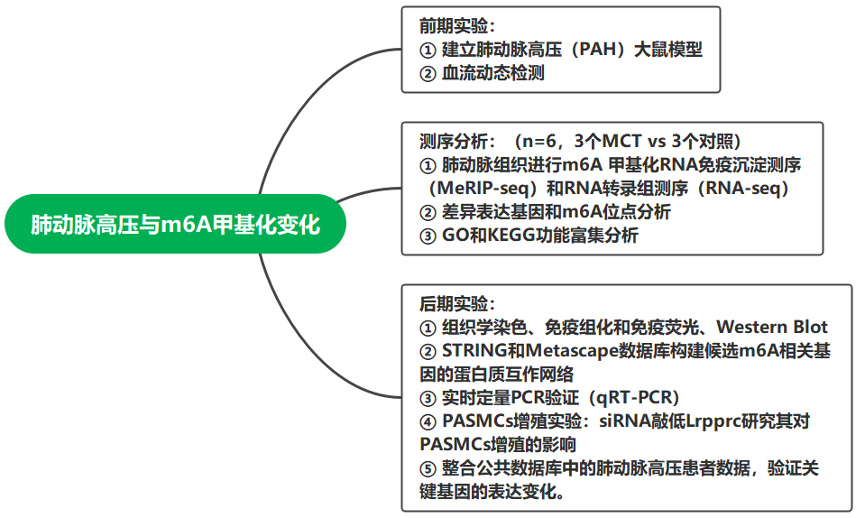
研究结果
(1)PAH大鼠模型的m6A基本特征
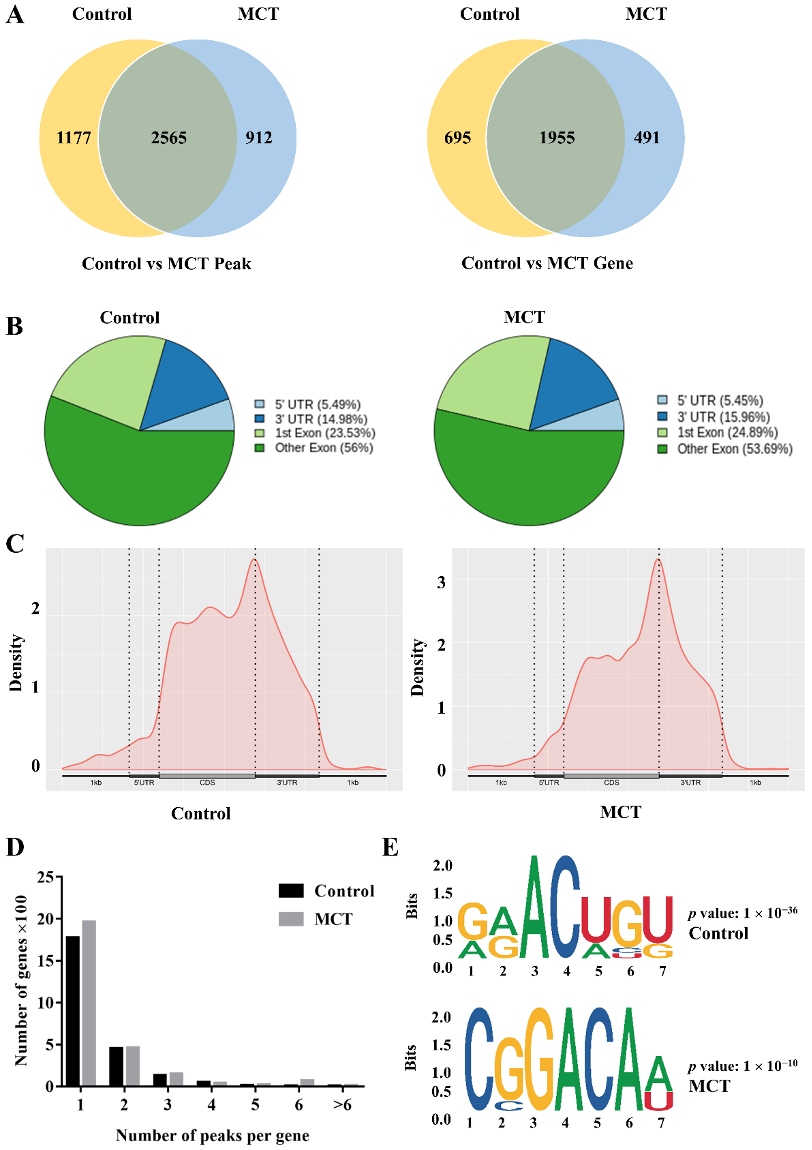
图1: PAH大鼠模型的m6A基本特征。组织来自肺动脉,每组n=3。
A. 维恩图显示了两组中m6A peaks(左)和基因(右)的重叠。
B. 饼图显示了转录本四个不重叠区域((5' UTR、CDS、3' UTR和其他区域)的m6A peaks百分比。
C. 密度曲线显示m6A peaks在转录本中的分布。转录本分为三部分,即5'UTR、CDS和3'UTR。
D. 两组不同数量m6A peaks的基因比例。
E. 两组RRACH motif情况。
m6A:N6-甲基腺苷;PAH:肺动脉高压;MCT:野百合碱;UTR:非翻译区;CDS:编码序列。
(2)PAH中的差异m6A分析
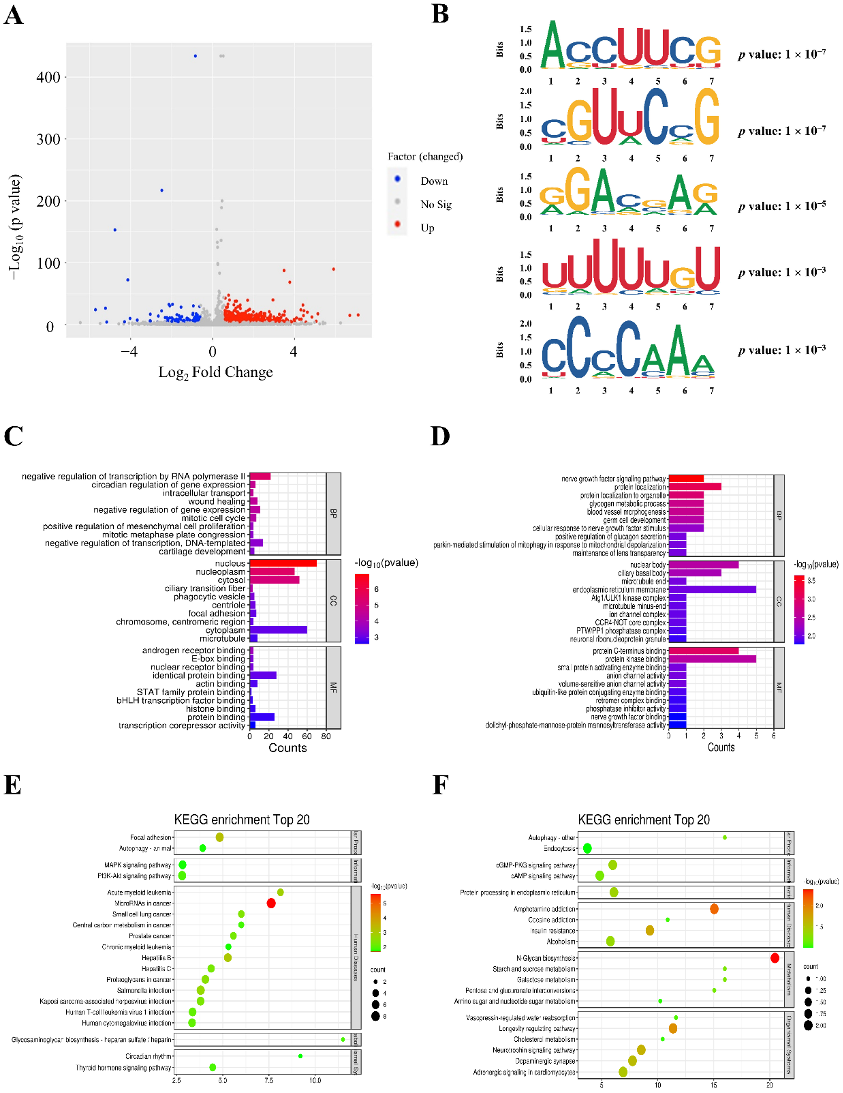
图2:PAH中的差异m6A分析。
A. 相对于对照组,MCT组中差异表达的m6A peaks火山图(| log2 FC |>0.585,p<0.05)。
B. 差异m6A peaks中富集的前五个motif。
C. 具有差异m6A的上调m6A标记的转录本GO分析。
D. 具有差异m6A的下调m6A标记的转录本GO分析。
E. 具有差异m6A的上调m6A标记的转录本KEGG分析。
F. 具有差异m6A的下调m6A标记的转录本KEGG分析。
FC:倍数变化;GO:基因本体论;KEGG:京都基因与基因组百科全书。
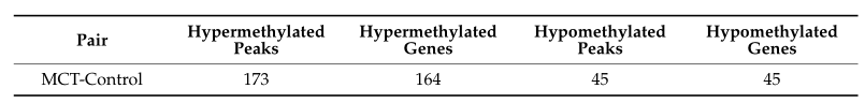
表1:差异甲基化m6A peaks和相关基因数
(3)m6A修饰基因的转录谱
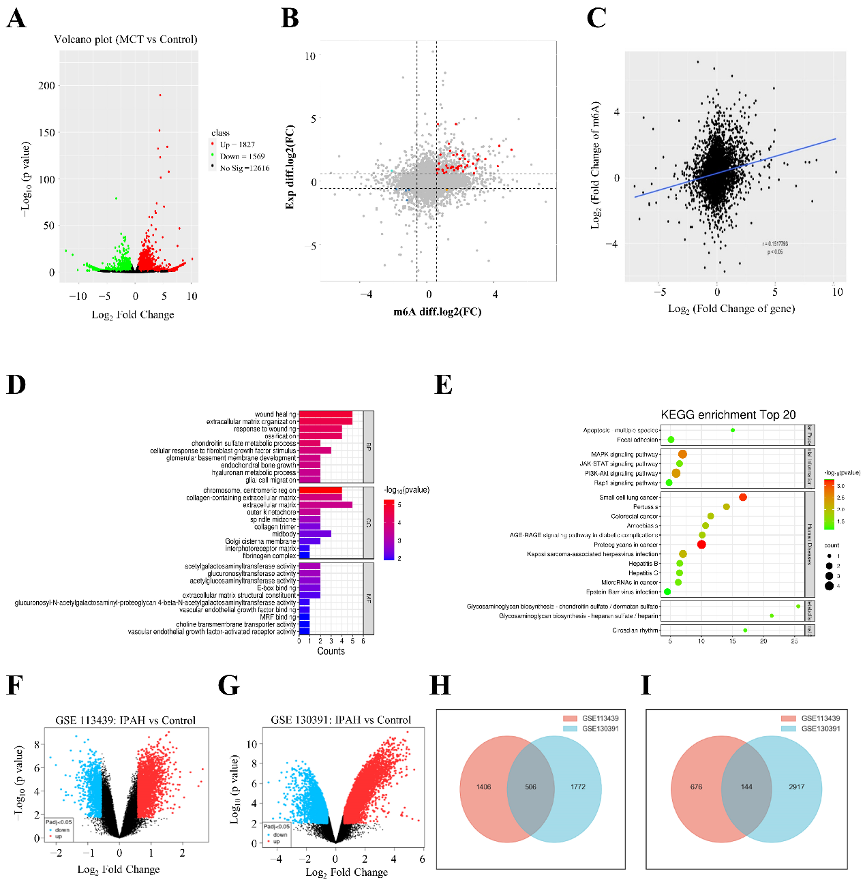
图3:m6A修饰基因的转录谱。
A. 差异表达基因的火山图。
B. 具有显著变化的peak差异表达基因的四象限图。
C. 总体m6A与mRNA表达水平呈正相关(r=0.1517793,p<0.05)。
D-E. GO和KEGG分析分别具有显著变化peak的差异表达基因。
F-G. 两个数据集的DEG分布的火山图。红点代表上调DEG,蓝点代表下调DEG,黑点代表非DEG。
H. 在两个数据集中同时上调的DEG。
I. 在两个数据集中同时下调的DEG。DEG:差异表达基因。
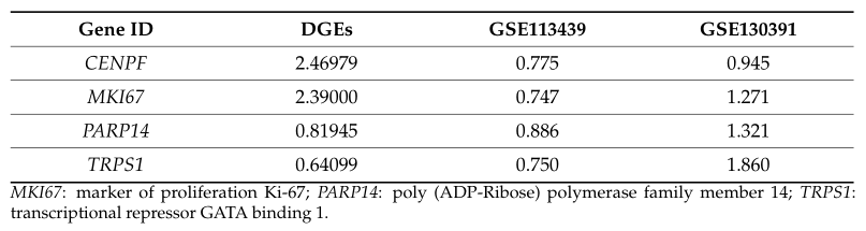
表2:数据库中基因的mRNA表达水平(Log2(FC)
(4)PPI网络建立和候选基因鉴定
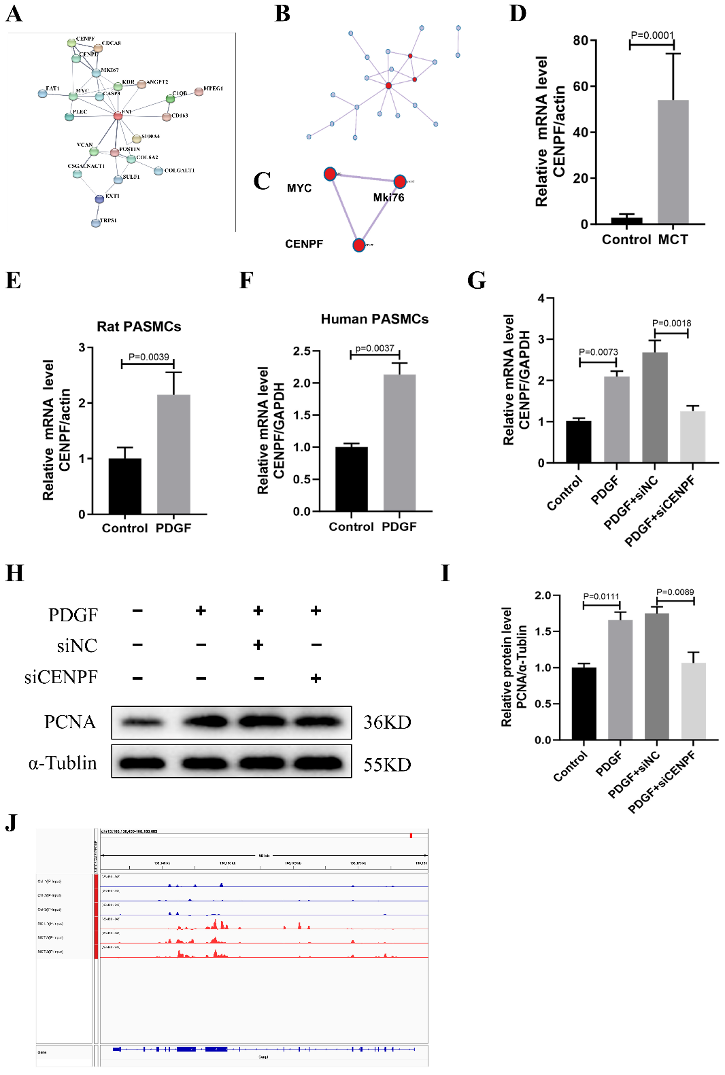
图4:蛋白质-蛋白质互作(PPI)网络建立和候选基因鉴定。
A–C. 基于上述基因构建的中枢网络。
D. MCT组和对照组(每组n=6)肺组织中Cenpf的相对mRNA表达,数据代表平均值±SEM,并使用Student t检验比较两组组间差异。
E. 血小板衍生生长因子BB(PDGF-BB)刺激(30 ng/mL)下,大鼠PASMC中Cenpf mRNA相对表达水平(每组n=3),以α-Tublin作为内部对照归一化。
F. 人类PASMCs在PDGF-BB刺激下的CENPF mRNA相对表达水平(每组n=3),以GAPDH作为内部对照归一化。
G. 用siRNA转染人PASMC 48h后,经PDGF-BB(30 ng/mL)再处理24h的CENPF mRNA相对表达水平(每组n=3)。
H-I. 以α-Tublin作为内部对照的PCNA蛋白水平的代表性Western blot和定量分析(每组n=3)。
J. 通过IGV观察到Cenpf mRNA转录本上的m6A水平。
PPI:蛋白质-蛋白质互作;SEM:平均值的标准误差;PASMCs:肺动脉平滑肌细胞;PDGF-BB:血小板衍生生长因子BB。
(5)肺动脉高压(PAH)的肺动脉中,leucine-rich pentatricopeptide repeat-containing (LRPPRC) 蛋白表达水平下降
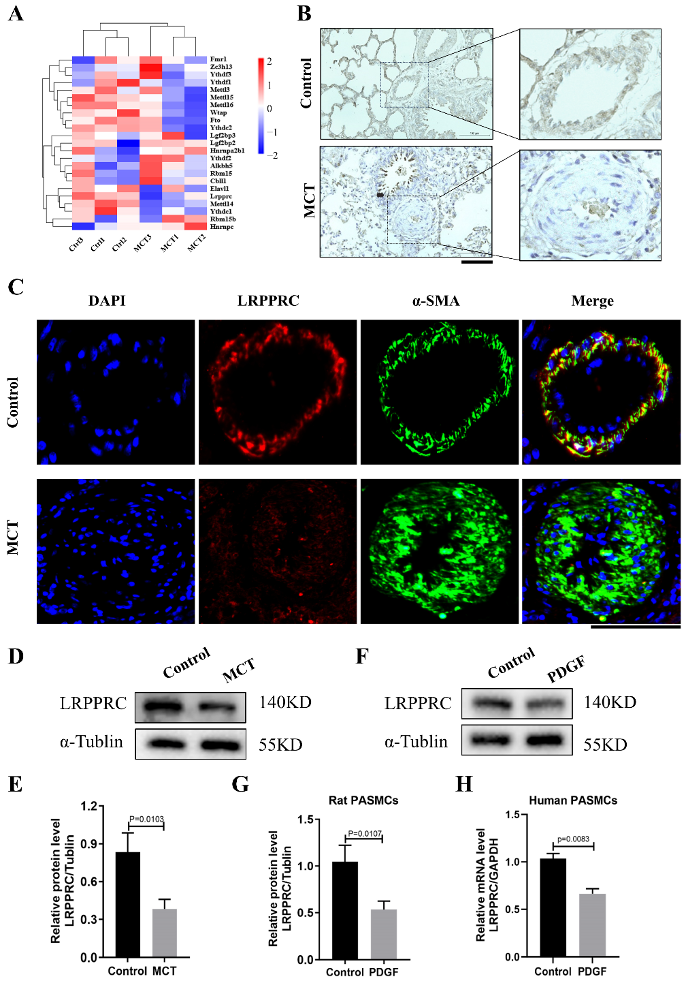
图5: PAH患者的肺动脉LRPPRC表达降低。
A. 两组(PAH和对照组)中23个m6A调控因子的表达情况热图。
B. 肺组织中LRPPRC的免疫组化染色(每组n=6),条形图=100µm(左图),放大的肺动脉(右图)。
C. 肺组织中LRPPRC的免疫荧光染色(每组n=6),血管染色图像(绿色)、目标蛋白染色图像(红色)、细胞核染色图像(蓝色),合并图像(橙色),条形图=50µm。
D-E. MCT和对照组肺组织中LRPPRC和α-Tubulin的代表性Western blot和定量分析(每组n=6);数据表示为均值±标准误(SEM),使用学生t检验比较两组。
F-G. 大鼠PASMCs在PDGF-BB刺激下的LRPPRC水平的代表性Western blot和定量分析(30 ng/mL),以α-Tubulin作为内部对照(每组n=3)。
H. 在PDGF-BB刺激下(30 ng/mL),人类PASMCs中LRPPRC相对mRNA表达水平,以GAPDH作为内部对照(每组n=3)。
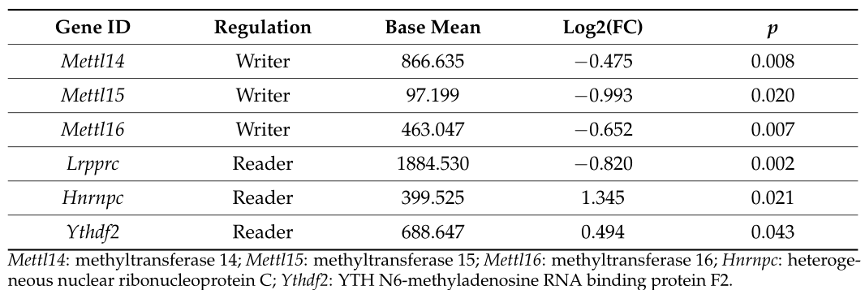
表3:m6A调控因子的mRNA表达水平
(6)LRPPRC下调促进PASMC增殖和Cenpf表达
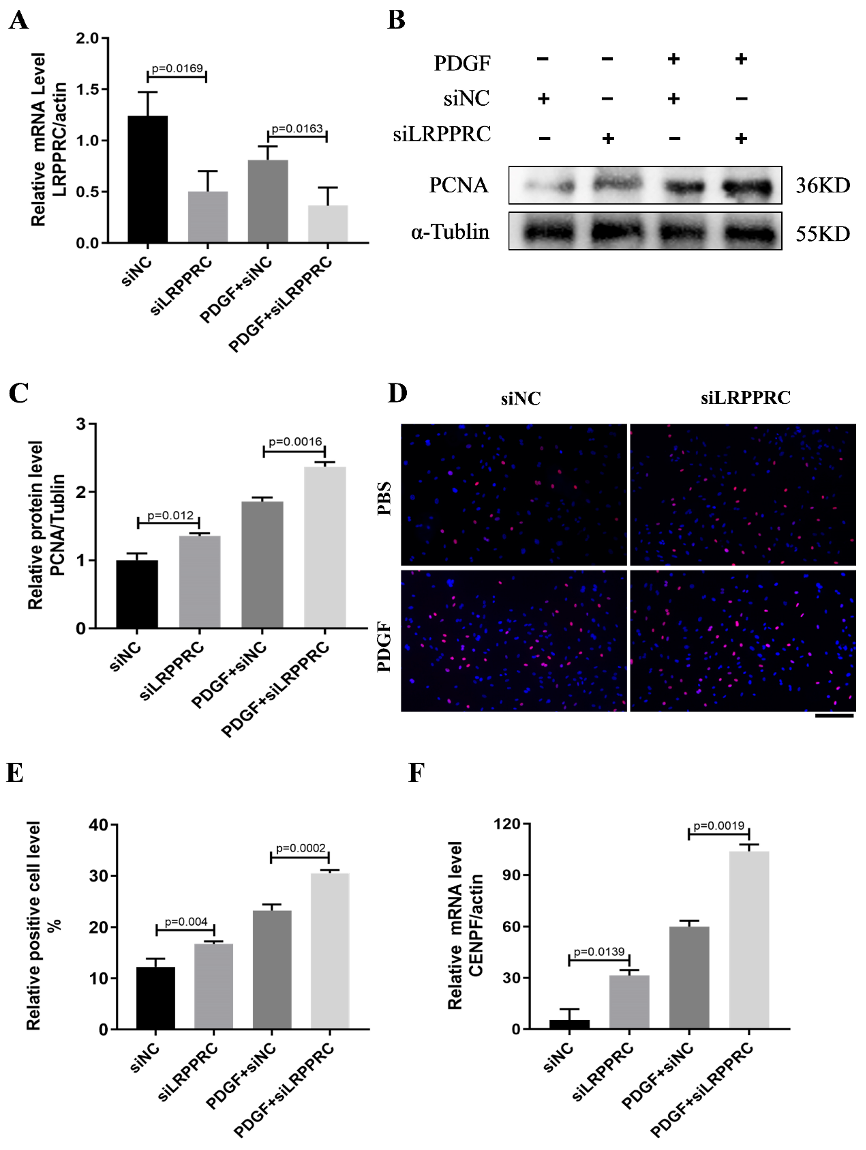
图6:LRPPRC下调促进肺动脉平滑肌细胞(PASMCs)的增殖和Cenpf表达。
A.在PASMCs中,用siRNA转染PASMC 48小时,然后用PDGF-BB(30 ng/mL)再处理24小时后,Lrpprc水平的相对mRNA表达(每组n=3)。
B-C. 代表性的Western blot和PCNA水平的定量分析,以α-Tubulin作为内部对照归一化(每组n=3)。
D. EdU掺入实验评估si-Lrpprc处理的PASMCs在PDGF-BB刺激下的细胞增殖能力。条形图=100µm。目标细胞为红色。
E.计算EdU染色的细胞比率。
F. Cenpf水平的相对mRNA表达(每组n=3)。
参考文献:
Feng Y, Yu Z, Tang M, Li J, Peng B, Juaiti M, Tang Y, Liang B, Ouyang M, Liu Q, Song J. Transcriptome-Wide N6-Methyladenosine Alternations in Pulmonary Arteries of Monocrotaline-Induced Pulmonary Arterial Hypertension in Rats and Novel Therapeutic Targets. Biomedicines. 2024 Feb 4;12(2) pii: biomedicines12020364. doi: 10.3390/biomedicines12020364. PubMed PMID: 38397966.
相关阅读:
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
3文读懂:m⁶A甲基化在动物肌肉发育中的重要作用(猪+鸡+山羊)