
近日,华东理工大学生物工程学院和生物反应器工程国家重点实验室叶邦策教授和尤迪副教授为共同通讯作者、符瑜博士为第一作者在微生物学领域著名期刊《mBio》上发表题为《A network of acetyl phosphate-dependent modification modulates c-di-AMP homeostasis in Actinobacteria》的科研成果。研究通过ChIP-seq等分析揭示乙酰磷酸(Acetyl Phosphate, AcP)依赖的乙酰化修饰网络在放线菌(Actinobacteria)中调控环二腺苷酸单磷酸(cyclic di-adenosine monophosphate,c-di-AMP)稳态的分子机制。研究以红色糖多孢菌(Saccharopolyspora erythraea,S. erythraea)为模型,揭示AcP通过乙酰化修饰影响两种关键蛋白:二腺苷酸环化酶(Diadenylate Cyclase, DisA)和其转录抑制因子DasR,从而调控c-di-AMP合成与降解,维持细胞内c-di-AMP稳态。其调控机制在放线菌中高度保守,并可能对细胞的生长、发育和抗生素合成产生重要影响。易基因科技为本研究提供ChIP-seq技术服务。

标题:A network of acetyl phosphate-dependent modification modulates c-di-AMP homeostasis in Actinobacteria(乙酰磷酸依赖的修饰网络调控放线菌中c-di-AMP稳态)
发表时间:2024-07-09
发表期刊:mBio
影响因子:IF6.4/Q1
技术平台:ChIP-seq等(易基因金牌技术)

本研究提出一个由乙酰磷酸(AcP)调控的网络,该网络通过DisA和DasR这两个不同的底物来负责c-di-AMP稳态。研究揭示了AcP诱导的乙酰化通过破坏蛋白质多聚体化来调控,从而通过DisA的K66位点乙酰化抑制c-di-AMP合成;而DasR的K78位点乙酰化则消除对disA的转录抑制。研究验证了AcP通过介导平衡c-di-AMP稳态发挥关键生理作用。进一步的研究表明,乙酰化的DisA和DasR发生了构象变化,这些变化在分化过程中发挥着至关重要的作用。鉴于AcP诱导的乙酰化在响应环境胁迫时的广泛分布以及所鉴定关键位点的高度保守性,研究人员提出c-di-AMP稳态调控可能是放线菌中心回路的一个基本特性,从而实现对细胞生理的整体调控。
研究要点
c-di-AMP鉴定对于细菌生长和细胞生理是必需的,因此本研究的主要挑战是细胞信号和刺激如何进入决定c-di-AMP浓度的决策过程,以及这些信息如何整合到调控通路中。研究以S. erythraea为模型验证了AcP依赖的DisA乙酰化及其转录抑制因子DasR参与协调环境信号和细胞内信号,这对于c-di-AMP稳态至关重要。
具体而言,DisA的K66位点乙酰化直接失活其二腺苷酸环化酶活性,从而抑制c-di-AMP产生,而DasR的K78位点乙酰化则导致disA表达增加和c-di-AMP水平升高。因此,AcP是c-di-AMP维持中的一个关键分子开关,它响应环境变化,可能抑制有效发育。因此,AcP介导的翻译后修饰(PTM)构成了合成酶/水解酶调控c-di-AMP稳态的网络。
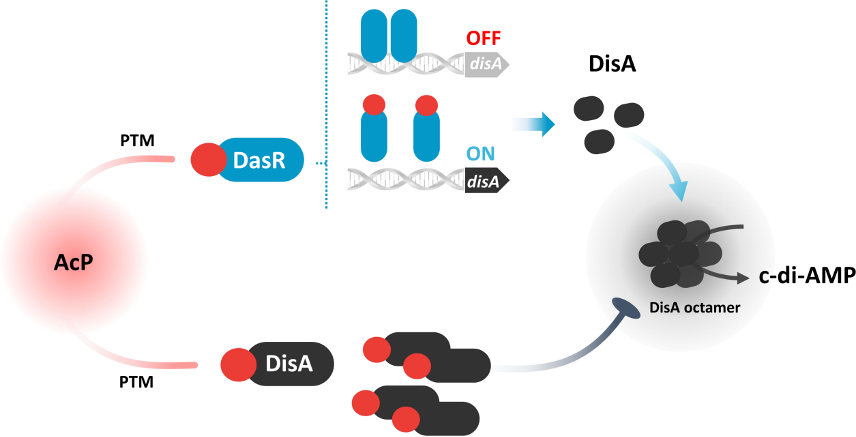
乙酰磷酸(AcP)调控c-di-AMP稳态通路示意图
研究方法
蛋白质乙酰化状态检测:通过免疫沉淀(Immunoprecipitation, IP)和免疫印迹(Immunoblotting, IB)分析检测DisA和DasR的乙酰化水平。
体外乙酰化实验:利用AcP对DisA和DasR进行体外乙酰化反应,验证其乙酰化位点。
质谱分析(LC-MS/MS):鉴定乙酰化修饰的位点,确定DisA的K66和DasR的K78为关键乙酰化位点。
酶活性检测:通过酶活性实验检测乙酰化对DisA二腺苷酸环化酶(DAC)活性的影响。
基因转录分析:利用实时定量RT-PCR(Real-time RT-PCR)检测disA基因的转录水平。
染色质免疫沉淀测序(Chromatin Immunoprecipitation Sequencing, ChIP-seq):分析DasR在基因组上的结合位点,验证其对disA基因的转录调控。
生物物理实验:圆二色光谱(Circular Dichroism, CD)分析、化学交联实验和生物层干涉(Biolayer Interferometry, BLI)实验,研究乙酰化对蛋白结构和DNA结合能力的影响。
细胞生理实验:通过扫描电子显微镜(SEM)观察不同突变株的发育表型。
结果图形
(1)AcP依赖的乙酰化直接抑制DisA的DAC活性
研究发现,在氮限制条件下,DisA乙酰化水平显著升高,且AcP能够直接乙酰化DisA。体外实验表明,乙酰化DisA的DAC活性降低约75%,表明AcP依赖的乙酰化显著抑制了DisA的酶活性。进一步的质谱分析鉴定出DisA的K66为关键乙酰化位点,位于其DAC结构域内,该位点乙酰化导致DisA八聚体结构解离,从而抑制其DAC活性,减少c-di-AMP合成。
图1:AcP诱导的DisA乙酰化抑制其DAC活性。
(A) 在氮充足(N+)或氮限制(N-)条件下,S. erythraea野生型(WT)菌株的DisA乙酰化水平。
(B) 在37°C下,使用10 mM AcP对His标签的DisA蛋白进行不同时间点(0、1、3和5h)的乙酰化处理。通过Western blotting使用特异性抗乙酰赖氨酸(anti-AcK)抗体检测乙酰化水平。
(C) DisA野生型(DisAWT)和乙酰化DisA(DisAAcP)蛋白的DAC活性。
(D) DisAWT和DisAAcP蛋白的圆二色光谱(CD)图。
(E) DisA的结构域组织以不同颜色的方框表示。
(F) DisAWT、DisAAcP、DisAK66Q和DisAK66R蛋白的交联实验。
(G) DisAWT、DisAK66Q和DisAK66R蛋白的DAC活性。
(2)DisA主要在K66位点乙酰化时失活
通过构建DisA的K66突变体(K66Q和K66R),研究发现K66Q突变体的八聚体结构显著减少,DAC活性亦显著降低,而K66R突变体表现出与野生型相似活性。这表明K66位点乙酰化是DisA失活的主要原因。此外,过表达DisAK66Q的菌株中c-di-AMP水平显著降低,进一步验证K66乙酰化对c-di-AMP合成的抑制作用。
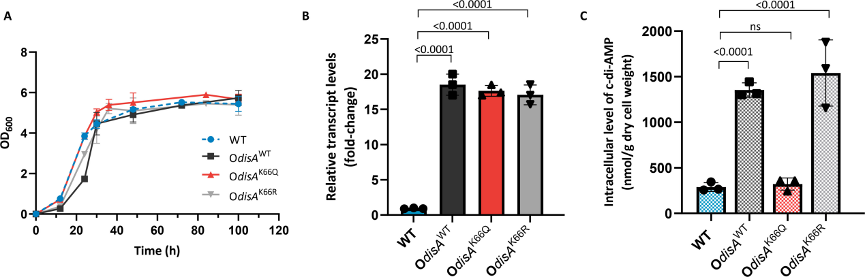
图2:K66乙酰化对体内c-di-AMP合成的影响。
(A) S. erythraea野生型(WT)、过表达DisAWT(OdisAWT)、过表达DisAK66Q(OdisAK66Q)和过表达DisAK66R(OdisAK66R)菌株在30°C下TSB培养基中培养的生长曲线。
(B) 在TSB培养基中培养的WT、OdisAWT、OdisAK66Q和OdisAK66R菌株中disA基因的转录水平。
(C) 在TSB培养基中培养的WT、OdisAWT、OdisAK66Q和OdisAK66R菌株的细胞提取物中细胞内的c-di-AMP水平。
参考文献:
Fu Y, Zhao L-C, Shen J-L, Zhou S-Y, Yin B-C, Ye B-C, You D. A network of acetyl phosphate-dependent modification modulates c-di-AMP homeostasis in Actinobacteria. mBio. 2024 Jul 9:e0141124. doi: 10.1128/mbio.01411-24.