
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
近日,山东第一医科大学附属肿瘤医院(山东省肿瘤医院)/山东省精准肿瘤学重点实验室宋倩博士等为第一作者、陈大卫研究员和于金明院士共同通讯作者,在《Cell Reports》期刊上发表题为“Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid”的研究论文,研究揭示了非小细胞肺癌(NSCLC)患者肠道菌群的显著变化,特别是动物双歧杆菌(Bifidobacterium animalis,简称B. animalis)在NSCLC患者粪便中显著减少。研究综合多种实验模型和分析方法,发现B. animalis及其代谢产物吲哚-3-乙酸(indole-3-acetic acid,简称IAA)通过肠-肺轴共同抑制NSCLC进展。具体而言,B. animalis来源的IAA激活宿主芳香烃受体(AHR),抑制METTL3介导的m6A甲基化修饰,进而抑制STAT3和IL-6表达,最终增强抗肿瘤免疫反应。该研究不仅为NSCLC的预防和治疗提供了新视角,还强调了肠道菌群及其代谢产物在癌症发生和发展中的重要作用。深圳易基因为本研究提供m6A甲基化测序(MeRIP-seq)技术服务,助力揭示B. animalis和IAA抑制NSCLC进展的表观转录组调控机制。

标题:Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid(动物双歧杆菌通过吲哚-3-乙酸抑制肺癌进展并调节肿瘤免疫)
发表时间:2025年8月26日
发表期刊:Cell Reports
影响因子:IF6.9/Q1
技术平台:宏基因组测序、代谢组学、MeRIP-seq、RNA-seq(易基因金牌技术)
作者单位:山东第一医科大学附属肿瘤医院(山东省肿瘤医院)/山东省精准肿瘤学重点实验室
DOI:10.1016/j.celrep.2025.116132
近年相关研究表明,肠道菌群及其代谢产物在NSCLC发生发展中具有重要作用。本研究发现,NSCLC患者与健康对照者的肠道菌群组成存在显著差异,尤其动物双歧杆菌(B. animalis)在NSCLC患者中显著减少。B. animalis在两种NSCLC小鼠模型和NSCLC细胞系中均能抑制肿瘤进展,研究整合代谢组学进一步揭示,吲哚-3-乙酸(IAA) 是B. animalis的关键代谢物,存在显著抗NSCLC活性。具体而言,B. animalis及其IAA通过激活肺部芳香烃受体(AHR),抑制METTL3介导的STAT3 m6A甲基化;同时通过抑制IL-6减少M2型巨噬细胞极化并增强CD8+ T细胞功能,从而通过肠-肺轴调节抗肿瘤免疫。B. animalis与IAA的补充为NSCLC预防提供了潜在策略。
核心发现
l B. animalis在非小细胞肺癌(NSCLC)患者的粪便中显著减少。
l B. animalis通过其代谢产物IAA和肠-肺轴抑制NSCLC的进展。
l B. animalis代谢产物IAA通过AHR/METTL3/STAT3轴抑制NSCLC。
l B. animalis和IAA改善NSCLC中的肿瘤免疫。
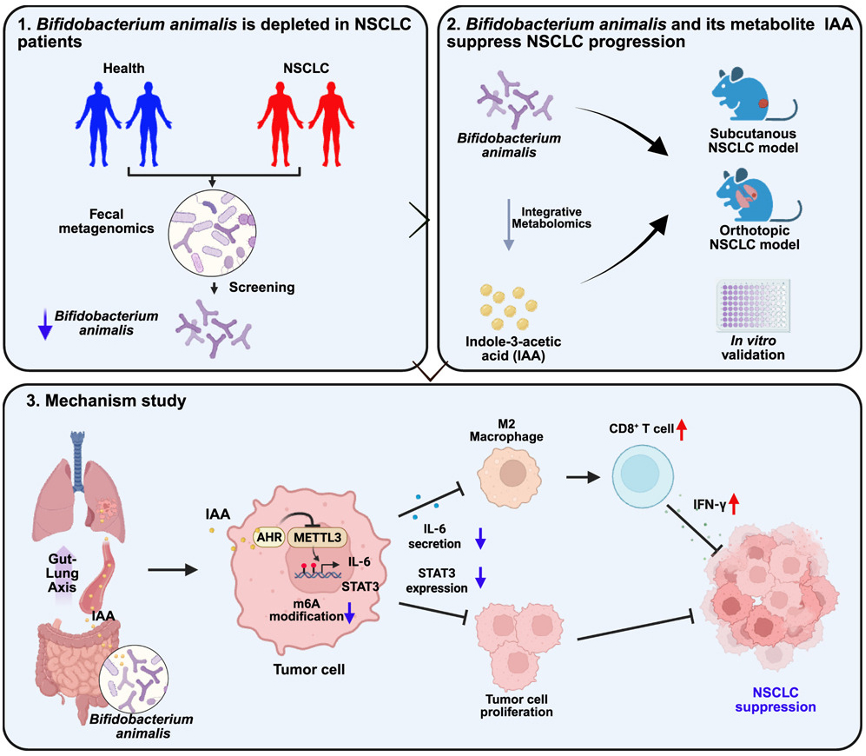
研究摘要
易小结
本研究从肠道菌群与肺癌关联角度,突出了肠-肺轴在肿瘤发生中的重要性。该研究为未来利用肠道菌群干预和表观遗传调控进行疾病治疗提供了理论基础和实践方向,有望推动个性化医疗的发展,为癌症等复杂疾病的攻克提供新的策略和工具。
易基因多组学技术的整合应用(如代谢组学、RNA-seq和m6A MeRIP-seq),揭示了表观转录组调控在肿瘤抑制中的新机制,为未来靶向m6A修饰的癌症治疗策略提供了新视角。
研究方法
研究方法部分涉及多项实验技术,包括临床样本分析、动物模型构建、细胞实验和分子生物学检测。
微生物组学测序:收集27例NSCLC患者和29例健康对照的粪便样本,进行宏基因组测序以比较肠道菌群组成;16S rRNA测序和PCR验证B. animalis丰度变化。
动物模型实验:皮下接种LLC细胞的异种移植模型和原位注射CMT167-Luc细胞的原位模型,通过灌胃给予B. animalis或其代谢产物IAA,评估肿瘤体积、重量和免疫细胞浸润。
细胞实验:在体外培养的NSCLC细胞中,测试B. animalis条件培养基(Ba-CM)和IAA对细胞增殖、凋亡、周期和蛋白表达的影响。
代谢组学:非靶向和靶向代谢物分析,鉴定B. animalis产生的关键代谢产物。
m6A测序(MeRIP-seq):分析B. animalis和IAA对NSCLC细胞中m6A修饰的影响。
此外还使用分子对接、表面等离子共振(SPR)结合实验、RT-qPCR、Western blot和流式细胞术等技术验证分子互作和免疫调节。
结果图形
(1)B. animalis在NSCLC患者粪便样本中减少
本研究通过宏基因组学分析发现,NSCLC患者肠道菌群多样性降低,且B. animalis在患者组中显著缺失。主坐标分析(PCoA)显示患者与健康对照的微生物组成存在差异,而线性判别分析(LEfSe)进一步确认B. animalis是NSCLC相关的缺失菌种。通过PCR验证,B. animalis在患者粪便中的丰度与肿瘤标志物(如CEA和CYFR21-1)呈负相关,提示其可能作为NSCLC的生物标志物。这一结果奠定了研究的基础,表明肠道菌群失调与NSCLC发生相关。
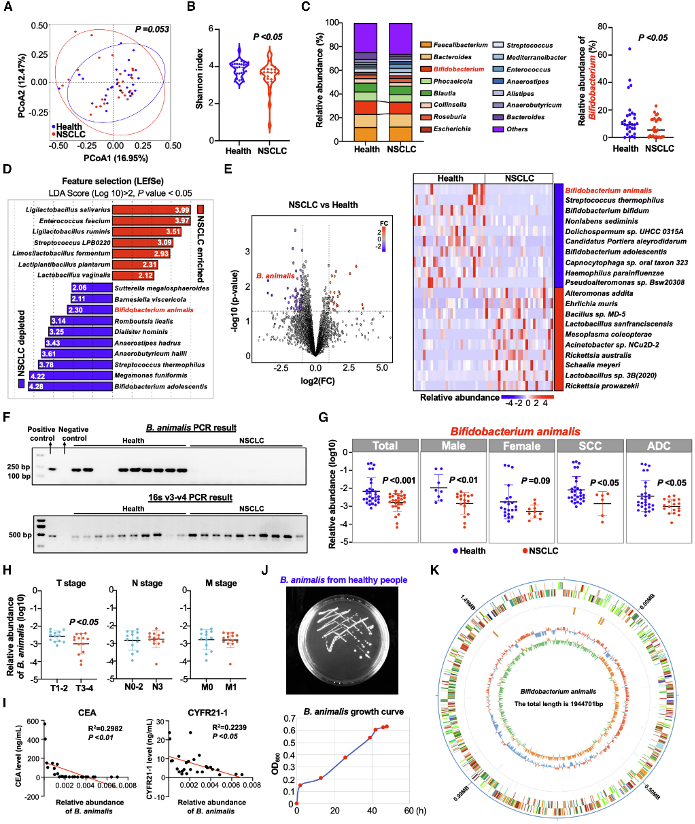
图1:NSCLC患者与健康个体的微生物群落谱
(2)从健康人粪便中分离的B. animalis抑制NSCLC肿瘤发生
在小鼠模型中,通过口服给予B. animalis,研究发现其能显著抑制NSCLC肿瘤的进展,表现为肿瘤体积和重量的减少。此外,B. animalis处理组小鼠肿瘤组织中细胞增殖标志物Ki-67表达降低,TUNEL阳性细胞增加,表明B. animalis抑制肿瘤细胞增殖并促进细胞凋亡。体外实验显示,Ba-CM处理抑制A549和PC9细胞生长,并诱导G1/S期阻滞和凋亡。这些数据表明B. animalis具有直接的抗肿瘤效应,且其作用优于其他细菌对照。
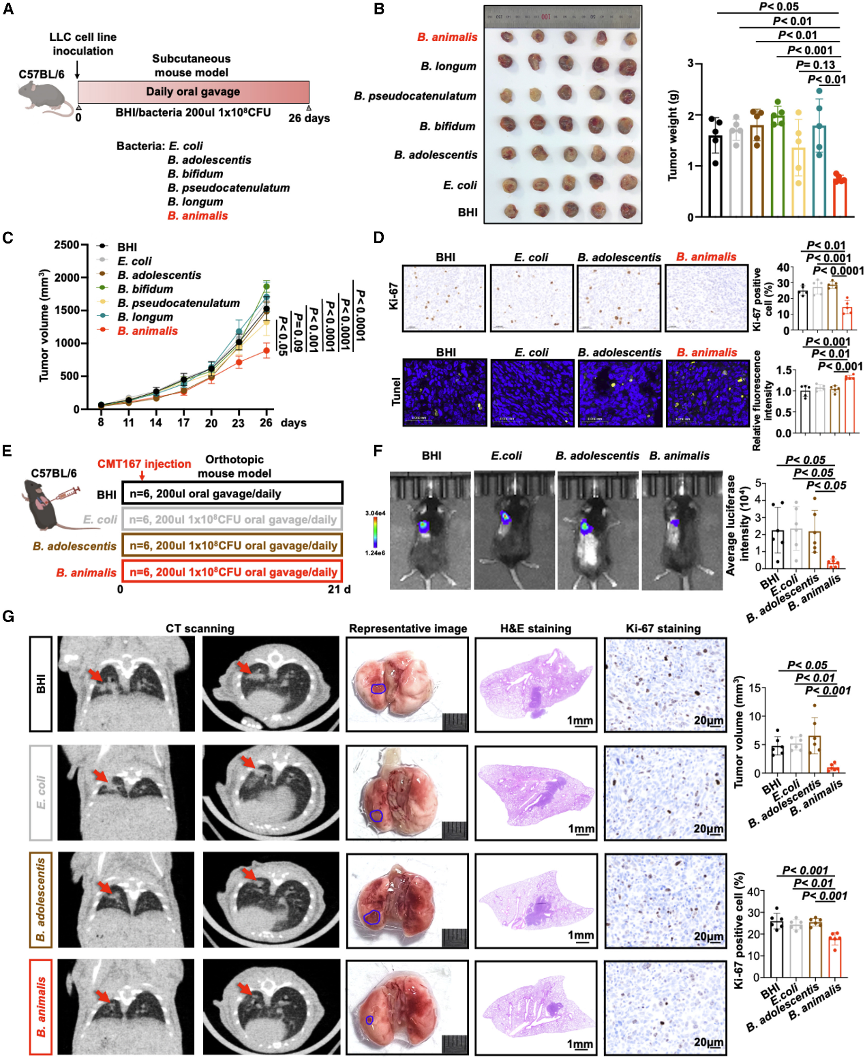
图2:B. animalis在体内和体外抑制NSCLC肿瘤发生
(3)B. animalis产生IAA作为其功能性肿瘤抑制代谢物
代谢组学分析发现,Ba-CM中吲哚类代谢物显著富集,其中IAA是B. animalis的关键产物。在无菌小鼠模型中,灌胃B. animalis后,IAA在粪便、血清和肺组织中均升高,证实IAA能通过肠-肺轴转运至肺部。体外实验表明,IAA直接抑制NSCLC细胞增殖,其效应与Ba-CM相似,提示IAA是B. animalis发挥功能的主要介质。

图3:细菌上清液和无菌小鼠的代谢组分析鉴定出IAA是B.animalis的主要代谢物
(4)IAA在体内外模拟B. animalis效应
在CMT167原位和和皮下NSCLC小鼠模型中,IAA处理显著抑制肿瘤生长,表现为肿瘤荧光强度减弱和肿瘤体积缩小。体外实验也证实IAA能抑制NSCLC细胞的增殖,促进细胞周期阻滞和凋亡,并下调增殖相关蛋白(如PCNA和cyclin D1)的表达。这些结果验证了IAA能复制B. animalis的抗肿瘤作用,强调了代谢物在机制中的核心地位。

图4:IAA在原位和皮下NSCLC小鼠模型中均抑制肿瘤生长
(5)B. animalis和IAA通过减少METTL3介导的m6A修饰以抑制STAT3表达
通过RNA-seq测序和m6A测序(MeRIP-seq),研究发现B. animalis和IAA处理的NSCLC细胞中METTL3表达下调,m6A修饰减少,特别是STAT3 mRNA的m6A修饰显著降低。
RNA-seq分析显示,B. animalis处理介导METTL3表达下调。而m6A MeRIP-seq进一步证实Ba-CM处理导致全基因组m6A peaks减少,尤其是在STAT3 mRNA中,表明METTL3介导的m6A甲基化被抑制,导致STAT3表达下降,从而抑制肿瘤细胞增殖。RNA-seq和MeRIP-seq整合分析表明B. animalis和IAA通过抑制METTL3介导的m6A修饰抑制STAT3表达。
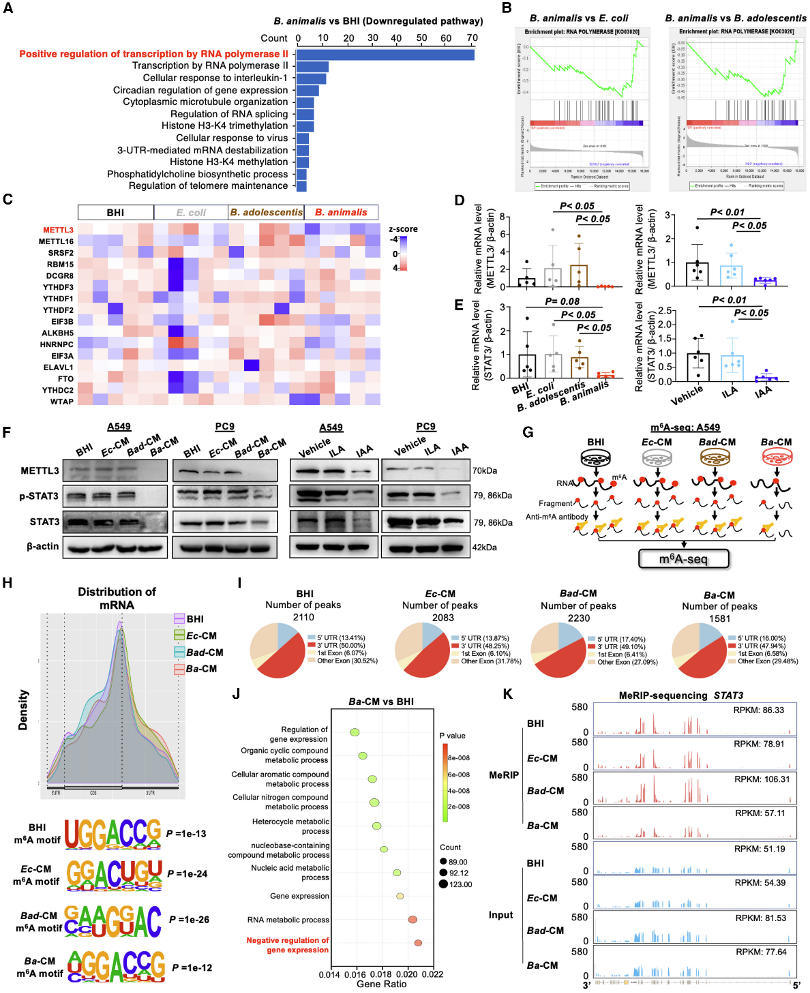
图5:B.animalis及其代谢产物IAA通过减少METTL3介导的m6A修饰以抑制STAT3表达
(A-B) RNA-seq揭示B.animalis组中RNA聚合酶相关通路显著减少(每组n=5)。
(C) RNA-seq显示B.animalis处理组中METTL3下调。
(D) 在LLC皮下小鼠模型中,RT-qPCR发现B.animalis(n=5)和IAA(n=6)抑制METTL3。
(E) RT-qPCR发现LLC皮下小鼠模型中B.animalis和IAA抑制STAT3。
(F) Western blot证实A549和PC9细胞系中Ba-CM和IAA显著抑制METTL3、STAT3和p-STAT3。
(G) m6A-seq流程图。
(H) 在A549细胞中,经Ba-CM、Ec-CM、Bad-CM或BHI处理后,m6A peaks在mRNA的5'UTR、CDS和3'UTR的归一化分布及特定的m6A motif(GGAC)。
(I) 经Ba-CM、Ec-CM、Bad-CM或BHI处理的A549细胞中m6A peaks数量。
(J) 与BHI处理细胞相比,Ba-CM处理细胞中差异m6A甲基化基因富集分析。
(K) 在BHI、Ec-CM、Bad-CM和Ba-CM中,STAT3的归一化m6A reads密度水平。Ba-CM处理后STAT3 mRNA的m6A peaks显著减少。
(6)IAA激活AHR以通过METTL3/STAT3轴抑制NSCLC进展
分子对接和SPR实验证实IAA能与AHR受体结合。HR抑制剂CH-223191部分抵消了B. animalis和IAA的抗肿瘤效果。Western blot分析显示,AHR抑制后,METTL3、STAT3和p-STAT3表达恢复,证实了AHR/METTL3/STAT3轴通路。这一结果将微生物信号与宿主表观遗传调控联系起来,突出了IAA-AHR互作的中心角色。
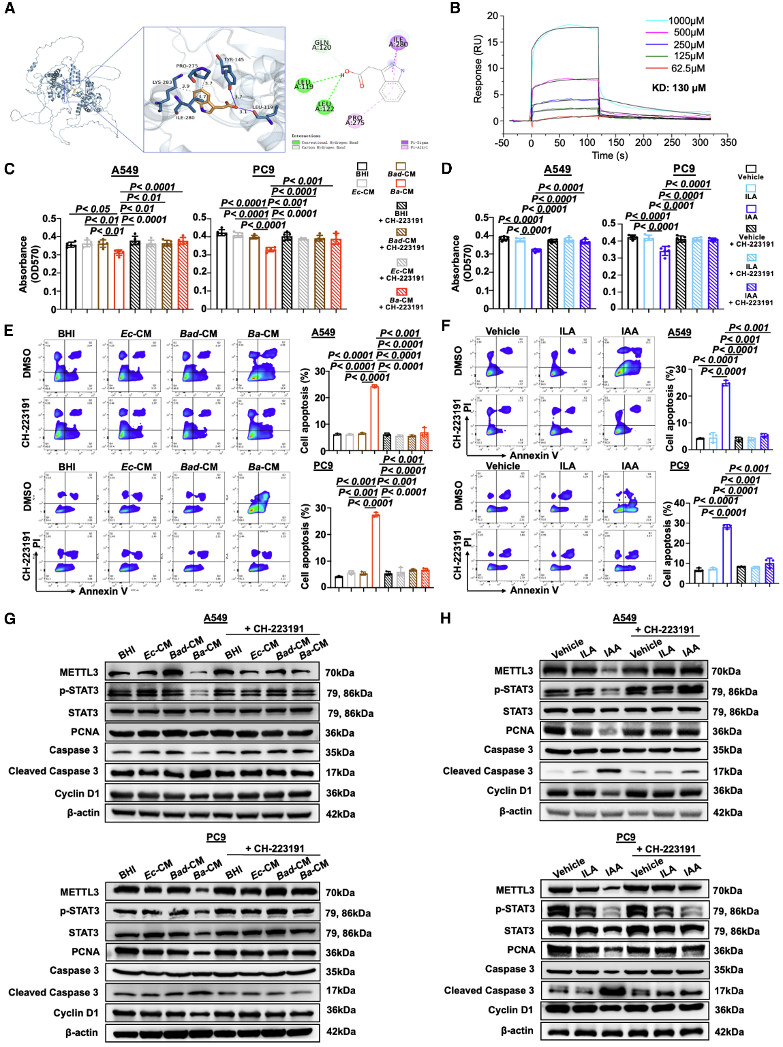
图6:IAA通过激活AHR抑制METTL3/STAT3轴,进而抑制NSCLC进展
(7)B. animalis和IAA增强抗肿瘤免疫以抑制NSCLC进展
通过流式细胞术和多色免疫组化,研究发现B. animalis和IAA处理减少肿瘤相关巨噬细胞(TAMs)的M2极化,增加M1型TAMs和CD8+ T细胞浸润。具体而言,Ba-CM抑制IL-6表达,而m6A-seq显示IL-6 mRNA m6A修饰减少,表明B. animalis通过调节IL-6来改善免疫微环境。CD8+ T细胞耗竭实验增强CD8+ T细胞的细胞毒性功能。这些结果表明B. animalis和IAA通过增强抗肿瘤免疫反应抑制NSCLC。
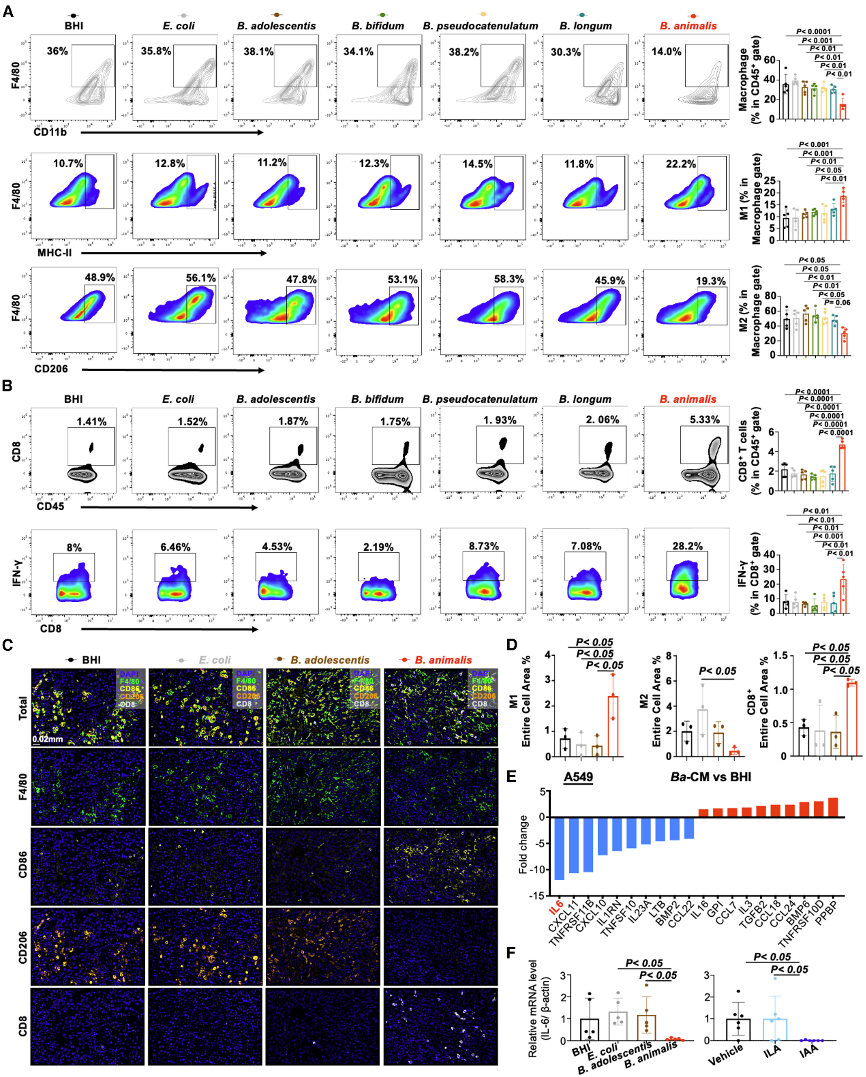
图7:B. animalis通过抑制IL-6调节抗肿瘤免疫以抑制NSCLC进展
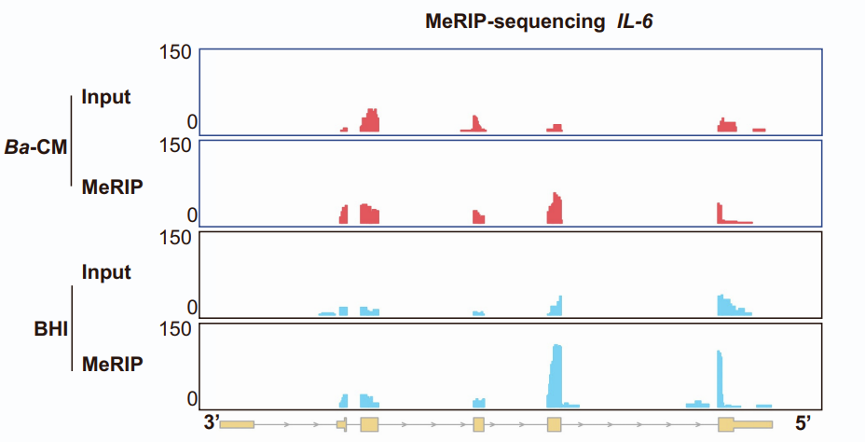
图8:m6A MeRIP-seq测序分析显示,Ba-CM显著减少IL-6 mRNA的m6A peaks。
结论和启示
本研究揭示了NSCLC患者中肠道菌群的显著变化,特别是B. animalis的显著减少。研究通过多种实验模型和分析方法,证实了B. animalis及其代谢产物IAA通过肠-肺轴抑制NSCLC进展。具体而言,B. animalis代谢产物IAA激活宿主AHR受体,抑制METTL3介导的m6A修饰,进而抑制STAT3和IL-6表达,最终增强抗肿瘤免疫反应。
MeRIP-seq技术在本研究中的重要作用
通过m6A甲基化测序,研究者详细分析了B. animalis和IAA对NSCLC细胞中m6A修饰的影响。研究发现,B. animalis和IAA处理的细胞中METTL3表达下调,m6A修饰减少,特别是STAT3 mRNA的m6A修饰显著降低。这些结果不仅揭示了B. animalis和IAA抑制NSCLC进展的分子机制,还强调了m6A修饰在肿瘤发生中的重要作用。
参考文献:
Song Q, Li X, Li Q, Shang S, Ma S, Zhai Z, Sun F, Mo Y, Wei L, Wu M, Ma Y, Yu J, Chen D. Bifidobacterium animalis suppresses non-small cell lung cancer progression and modulates tumor immunity through indole-3-acetic acid. Cell Rep. 2025 Aug 12;44(8):116132.doi: 10.1016/j.celrep.2025.116132.